在国家自然科学基金委的资助下,中科院武汉物理与数学研究和国立新加坡大学的研究人员,在蛋白质相互作用动力学的核磁共振分析方法研究方面又取得新的进展,结果发表在《美国化学会志》上。
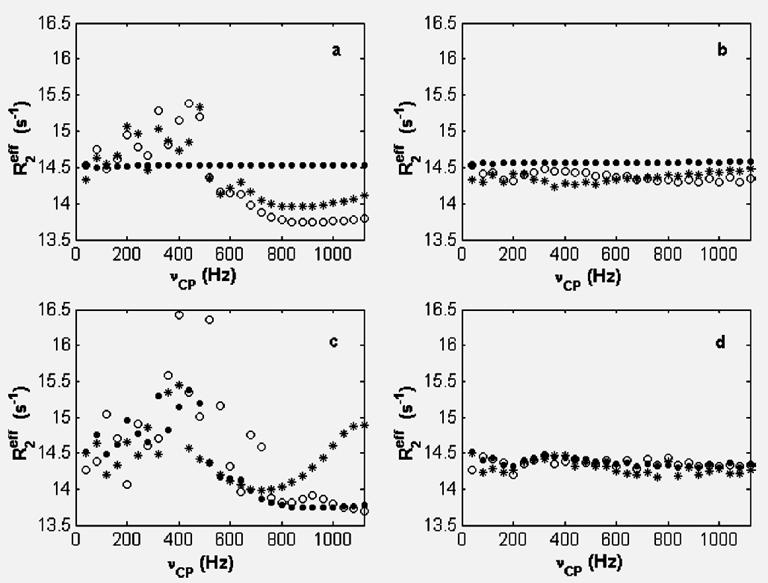
双方科研人员利用核磁共振(NMR)技术,在微秒-毫秒时间范围的动力学测定方法方面取得新进展,提出了一种新的相位循环机制,能够有效地消除多重自旋回波(CPMG)中偏置的共振信号重聚不完全等问题,从而有效降低频率偏置、射频不均匀,标量耦合,交叉弛豫等效应的影响,使蛋白质毫秒量级的动力学测定精度大为提高,为慢交换的准确测定提供新的技术(JACS, 2008, 130, 2432-2433)。
蛋白质相互作用动力学的研究有助于系统地了解蛋白质结构与功能的关系,并为新药靶点的发现和药物设计提供理论和实验基础。在这方面的研究中,NMR技术具有独特的优越性,是目前研究溶液中蛋白质等生物大分子的三维结构、主链和侧链运动特征及其与相互作用和功能的关系(构效关系)的最为有效的手段。双方合作人员曾发展了一种测定蛋白质侧链动力学特性的新方法,这种方法可以避免复杂的2H标记,比常规的NMR方法更易于使用(JACS, 2006, 128, 5073-5081)。