近日,中科院武汉物数所唐淳研究组与浙江大学医学院张纬萍副教授合作,在极弱蛋白-蛋白相互作用研究中获得重大进展,相关成果发表在《德国应用化学》(Angewandte Chemie)上,被选为热点文章(hot paper),并被推荐为cover story。(http://onlinelibrary.wiley.com/doi/10.1002/ange.201407928/abstract)
在细胞信号传递过程中,信号在蛋白之间通过相互作用进行传递,如磷酸基团的传递。然而,蛋白质相互作用的强度差异极大,解离常数(KD)在1 nM以下的相互作用,被称为stable interaction,1 nM - 1 mM间的相互作用,被称为transient interaction。由于研究方法缺乏,KD > 1 mM的相互作用复合物结构难以解析,KD 在1-5 mM的相互作用,国际上也仅有个别报道。目前,对蛋白质弱相互作用的结构与功能研究已逐渐成为国际研究的热点。越来越多的证据显示,弱相互作用广泛存在,且具有重要的生物学功能。那么,可检测到的弱相互作用有多少,在极弱的蛋白-蛋白相互作用中,是否仍然具有生物学功能?
核磁共振(NMR)是研究蛋白质之间弱相互作用的主要方法,但经典的方法如NOE,RDC和常规的顺磁弛豫增强的方法研究的蛋白复合体相互作用极限为KD < 10 mM的复合体。在本研究中,唐淳研究组发展了一种新颖的灵敏并且长程的顺磁弛豫增强的方法,引入基于镧系金属 Gd3+ 的、极为刚性的顺磁探针,极大提升了检测灵敏度,最终成功获得了KD ≈ 25 mM的蛋白质相互作用复合物结构。通过分子动力学模拟,发现复合物的存在时间< 1 ms,作者将这种极弱的、存在时间极短的相互作用,命名为fleeting interaction。结构分析进一步发现,相互作用极弱的原因在于疏水作用的存在使两者之间发生相互作用,但由于相互作用界面同为负电,导致电荷排斥。
上述的极弱相互作用的复合体中的两个蛋白是大肠杆菌磷酸转移酶系统中的 EI 和 EIIAGlc 蛋白,它们之间能够进行磷酸基团的传递。一般而言,细胞内信号蛋白浓度增加(许多蛋白的局部浓度可高达10 mM左右),则信号传递速度加快。作者模拟研究发现当蛋白浓度超过1 mM时,则与之匹配的KD必须大于1 mM,否则会造成信号传递“拥堵”,使信号蛋白浓度增加带来的“红利”消失。
该工作是武汉物数所学科交叉取得的又一重要成果,不仅证明了细胞内信号蛋白之间存在极弱相互作用,还提出了极弱相互作用存在的意义,为蛋白-蛋白相互作用的研究、以及细胞信号传递的研究提供了新的方法,打开了新的视野。
该工作得到了科技部、国家自然科学基金委,以及美国霍华德·休斯医学研究所(HHMI)基金的支持。
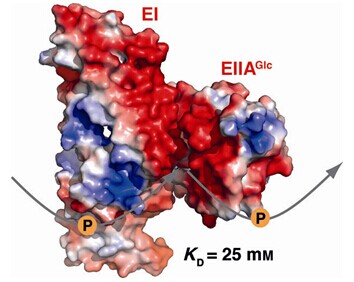
(细菌磷酸转移系统(PTS)的两个蛋白EI和EIIAGlc 之间通过极弱的相互作用,形成瞬态相互作用复合物,磷酸基团可由EI直接传递给EIIAGlc。相互作用复合物结构显示,两个蛋白通过疏水作用产生相互作用,由于两个蛋白相互作用的界面均为负电荷,导致相互作用极弱。 )


