由于抗生素滥用,近年来频现的超级细菌正严重威胁着人类的生命健康。双组分信号转导系统( Two-component signal transduction system,TCS)是细菌体内最重要的信号转导系统,调控着细菌的大部分生命活动。细菌的双组分信号转导系统作为潜在的新型抗菌药物靶标,一直是国际研究的热点。
超级细菌(图片来源网络)
双组分信号转导系统由组氨酸激酶( Histidine Kinase, HK)和反应调节蛋白( Response Regulator, RR)组成。如同接力赛中,队员之间传递接力棒般,它们之间通过磷酸基团的传递实现信号的转导,磷酸化后的应答调节蛋白可以调控一些特殊基因的表达。HK蛋白是细菌的感应器,通过感知不同的环境条件从而做出相应的响应。
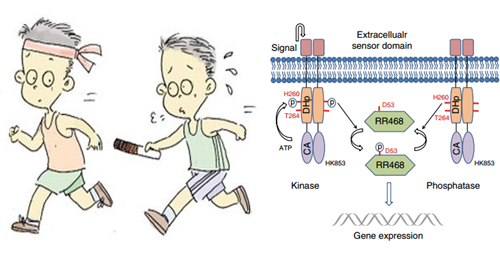
(左图图片来源:网络 右图:双组分信号转导通路示意图)
大多数细菌体内存在数十对双组分信号转导系统,它们调控了细菌绝大多数生理过程,包括细菌的趋化性、感知渗透压、孢子的形成、营养元素的代谢以及次级代谢产物的生物合成等诸多生理过程。以大肠杆菌为例,它的基因组编码了 62 种 TCS 蛋白,参与调控趋药性、新陈代谢和转运等多个生理过程。
早前,研究人员发现,鼠伤寒沙门氏菌以胞吞的方式入侵宿主细胞。沙门氏菌双组分系统通过感知环境pH的变化,在沙门氏菌的感染及释放过程中发挥了重要的作用。在这个过程中,双组分系统中的组氨酸激酶会实现不同功能的切换,但是具体的分子机制并不清楚。
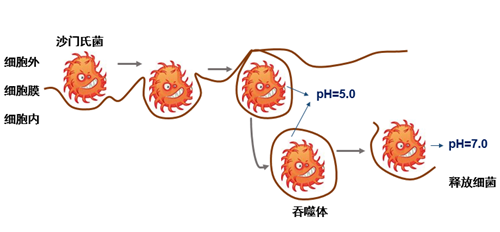
(沙门氏菌侵染宿主细胞示意图)
近日,中国科学院武汉物理与数学研究所姜凌研究员指导的研究团队在《Nature Communications》综合期刊上在线发表题为“A pH-gated conformational switch regulates the phosphatase activity of bifunctional HisKA-family histidine kinases”的研究论文。姜凌课题组通过与和美国杜克大学以及武汉病毒所的研究人员合作,成功捕获磷酸传递过程中的蛋白质瞬态复合物。研究人员发现双功能蛋白HK853酶活受pH调控,酸性环境下HK853会发生构象变化,使磷酸酶活性降低;研究人员进一步通过沙门氏菌双组分体系EnvZ-OmpR的胞内及胞外实验,发现pH变化调控毒力因子的表达,进而影响了细菌侵染能力,从而提出HisKA家族组氨酸激酶行使磷酸酶活性的酶促反应机理。
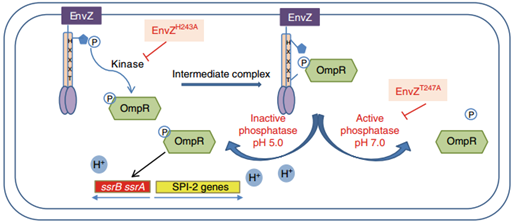
(沙门氏菌中,受pH调控的组氨酸激酶EnvZ酶活性选择机理)
由于双组分信号传导系统目前只在细菌、古生菌和植物中有发现,而在人类和其他哺乳动物体内尚未发现,因此可根据这一特点设计药物,将双组分转导系统作为药物靶标,只杀死细菌而对人体无害。该研究结果对了解细菌信号转导机制、耐酸性致病菌如沙门氏菌的毒力分泌机制以及新型抗菌药物的研发均具有重要的参考价值和指导意义。
该研究获得了中国科技部(#2017YFA0505400;#2013CB910200),国家自然科学基金((#21573280;#21603268),和美国国立医学科学研究所(GM115355)的基金资助。
附:论文链接


